Artículo original
Mejora del cumplimiento de las buenas prácticas de laboratorio clínico como resultado de una intervención
Improved compliance with good clinical laboratory practices as a result of an intervention
Yudeynis Marisol Díaz-Alonso1* https://orcid.org/0009-0004-1054-0243
Isis Patricia Rodríguez-Socarras2 https://orcid.org/0000-0002-4450-496x
Ubaldo Roberto Torres-Romo2 https://orcid.org/0000-0003-0852-4389
Dayamí Bembibre-Mozo2 https://orcid.org/0000-0003-0778-172X
Tahymiris Pérez-Milán3 https://orcid.org/0000-0003-4651-7294
1 Universidad de Ciencias Médicas. Hospital Pediátrico Provincial Eduardo Agramonte Piña. Departamento de Laboratorio clínico. Camagüey, Cuba.
2 Universidad de Ciencias Médicas. Departamento. Centro de Inmunología y Productos Biológicos (CENIPBI). Camagüey, Cuba.
3 Universidad de Ciencias Médicas. Hospital Pediátrico Provincial Eduardo Agramonte Piña. Departamento.Laboratorio Provincial de Biología Molecular. Camagüey, Cuba.
*Autor para la correspondencia: yude.cmw@infomed.sld.cu
RESUMEN
lntroducción: Las buenas prácticas de laboratorio clínico son esenciales para garantizar resultados confiables y de calidad en los análisis para el diagnóstico pediátrico. En Cuba su implementación es obligatoria según la regulación nacional (D3-2021), pero existen desafíos en su adopción.
Objetivo: Evaluar el cumplimiento de las buenas prácticas en el Laboratorio clínico del hospital pediátrico Eduardo Agramonte Piña de Camagüey.
Métodos: Se realizó un estudio de intervención, desde enero de 2022 a marzo de 2024, para evaluar el cumplimiento de las buenas prácticas en el Laboratorio clínico del hospital. El universo de estudio estuvo constituido por la organización (documentación, trabajadores, equipamiento, y otros recursos). Los datos fueron recogidos y procesados en un instrumento informático, estandarizado que incluye 10 apartados con 227 requisitos, se seleccionaron cuatro apartados en los que algunos de sus requisitos pueden gestionarse a nivel del laboratorio (gestión de documentación, gestión de recursos, gestión del proceso analítico y gestión de quejas y reclamaciones), después de la evaluación, se identificaron las no conformidades, se aplicó un plan de acción y se reevaluó el cumplimiento, los resultados se compararon.
Resultados: En la evaluación inicial el cumplimiento de las buenas prácticas de laboratorio clínico fue de 41 % (no cumple) con deficiencias en la documentación de todos los apartados y al aplicar las acciones correctivas, se alcanzó 66 % (cumple parcial).
Conclusiones: Como resultado del estudio de intervención, se mejoró el cumplimiento de las buenas prácticas de laboratorio, especialmente en la trazabilidad y reducción de errores, lo que impacta en la calidad del servicio pediátrico.
DeCS: LABORATORIOS CLÍNICOS; CONTROL DE CALIDAD; GARANTÍA DE LA CALIDAD DE ATENCIÓN DE SALUD; CALIDAD DE LA ATENCIÓN DE SALUD; GUÍA DE PRÁCTICA CLÍNICA.
ABSTRACT
Introduction: Good clinical laboratory practices are essential to ensure reliable, high-quality results in pediatric diagnostic analyses. In Cuba, their implementation is mandatory according to national regulations (D3-2021), but there are challenges in their adoption.
Objective: To evaluate compliance of good practices in the Clinical Laboratory of the Eduardo Agramonte Piña Pediatric Hospital in Camagüey.
Methods: An intervention study was conducted from January 2022 to March 2024 to evaluate compliance with good practices in the hospital's Clinical Laboratory. The study population consisted of the organization (documentation, staff, equipment, and other resources). The data was collected and processed using a standardized computerized tool that includes 10 sections with 227 requirements. Four sections were selected, some of which could be managed at the laboratory level (documentation management, resource management, analytical process management, and complaints and claims management). After the assessment, nonconformities were identified, an action plan was implemented, and compliance was reassessed. The results were compared.
Results: In the initial assessment, compliance with good clinical laboratory practices was 41% (non-compliant), with deficiencies in the documentation of all sections. After applying corrective actions, it reached 66% (partial compliance).
Conclusions: As a result of the intervention study, compliance with good laboratory practices improved, especially in traceability and error reduction, impacting the quality of pediatric services.
DeCS: LABORATORIES, CLINICAL; QUALITY CONTROL; QUALITY ASSURANCE, HEALTH CARE; QUALITY OF HEALTH CARE; PRACTICE GUIDELINE.
Recibido: 25/06/2025
Aprobado: 16/10/2025
Ronda: 1
INTRODUCCIÓN
En los últimos años, el concepto de calidad aplicado a los servicios de salud ha ganado cada vez más terreno. Ello no implica que históricamente estos servicios no hayan estado en pos de la excelencia, ya no se trata exclusivamente de poseer calidad, sino que esta sea percibida por el usuario.(1) Las buenas prácticas de laboratorio clínico (BPLC) son un conjunto de requisitos y actividades que aseguran que el servicio de laboratorio clínico sea competente para realizar determinados análisis y garantice la calidad y confiabilidad.(2)
Hoy día, reconocer que un laboratorio es competente para realizar determinados ensayos o proporcionar evidencias del adecuado cumplimiento de la regulación de BPLC vigente, constituye una necesidad por las implicaciones legales que conllevan los servicios de salud en el mundo.(3) En Cuba, las instituciones de salud cumplen funciones no sólo asistenciales, sino docente e investigativas, por lo que resulta necesario que sus servicios y áreas cumplan con los requisitos establecidos en las BPLC.(4)
El Centro para el Control Estatal de la Calidad de los Medicamentos, Equipos y Dispositivos Médicos (CECMED) en su condición de máxima autoridad, está facultado para aprobar o rechazar el otorgamiento de una certificación de BPLC, así como de aplicar las sanciones que se establecen en este reglamento.(5)
En el año 2019 fue evaluado el cumplimiento de los requisitos de las BPLC en el hospital pediátrico de Camagüey Eduardo Agramonte Piña, con la utilización de una guía, basada en la regulación 3-2009, resultando 75 requisitos cumplidos, para un 53,5 %.
En el año 2021 con la derogación de la regulación 3-2009,(6)y sustitución de la misma por la regulación D 3-2021 y como resultado de un análisis realizado por el comité de la calidad se decidió iniciar un proyecto de investigación con el objetivo de evaluar el grado de cumplimiento de las BPLC en el laboratorio clínico del hospital pediátrico Eduardo Agramonte Piña de Camagüey, desde enero de 2022 a marzo de 2024.
MÉTODOS
Se realizó una investigación en Sistema y Servicios de Salud a través de un estudio de intervención, desde enero de 2022 a marzo de 2024. El universo de estudio estuvo constituido por la organización (documentación, trabajadores, equipamiento, y otros recursos) en los cuales se realizó el diagnóstico del cumplimiento de los requisitos de las BPLC. La fuente de información primaria la constituyó un instrumento informático, estandarizado, diseñado y validado por un comité de expertos en el año 2021. Se estructuró en dos hojas de cálculo de Microsoft Excel 2016.
En el instrumento se incluyeron 10 apartados con 227 requisitos: Sistema de gestión de la calidad, gestión de la documentación, gestión de los recursos, gestión de compras y la contratación, gestión del proceso analítico, gestión de la información, auditorías internas, gestión de las no conformidades, gestión de las quejas y las reclamaciones y mejora de la calidad, los cuales fueron considerados como las variables de estudio.
Se seleccionaron cuatro de ellos: Gestión de documentación, gestión de recursos, gestión del proceso analítico y gestión de quejas y reclamaciones, que se pueden gestionar por la dirección del laboratorio con el objetivo de trabajar de forma progresiva y mejorar el cumplimiento de la resolución.
El procedimiento se realizó en dos etapas (diagnóstico inicial y después de aplicado el plan de acción).
El plan de acción se trazó por la dirección del laboratorio y fue revisado por la comisión provincial de BPLC e incluyó acciones cognoscitivas, organizativas, proyectivas e innovadoras; premisas, tanto generales como particulares, para establecer los juicios y coherencia a las acciones desarrolladas.
Técnica de procesamiento y análisis de los datos.
Se realizó la prueba de los rangos con signos de Wilcoxon para comparar muestras pareadas para variables ordinales, se trabajó con un 95 % de confiabilidad y una probabilidad de error inferior a 0,05 utilizando el paquete estadístico SPSS versión 23.0.
El cálculo de la estadística descriptiva (frecuencias absolutas, relativas y porcentaje) se realizó de forma automática mediante el SPSS.
El instrumento estableció una escala evaluativa de la forma siguiente:
Los resultados se reflejaron en tablas.
Implicaciones éticas
En la realización del estudio se tuvieron en cuenta los principios éticos que rigen las investigaciones biomédicas. Se contó con la aprobación de la dirección del hospital y del Comité de Ética de la Investigación en Salud y el Consejo Científico Provincial de la Salud, en la Universidad de Ciencias Médicas de Camagüey. La información fue utilizada solo con fines investigativos y se obtuvo el consentimiento informado del responsable del laboratorio.
RESULTADOS
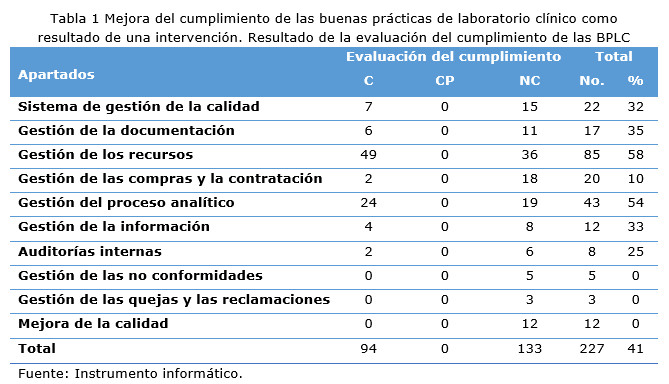
En la tabla 1 se observó que de los 227 requisitos solo se cumplieron 94 (41 %), la totalidad de los apartados no cumplieron y el laboratorio obtuvo una evaluación de NC, la gestión de las no conformidades, mejora de la calidad y la gestión de las quejas y las reclamaciones, con una menor puntuación 0 (0 %) respectivamente y la gestión de los recursos la que más puntuación alcanzó con 49 (58 %) (Tabla 1).
En la tabla 2 se pudo observar los resultados de la evaluación de la gestión de la documentación, antes y después de aplicado el plan de acción. En el diagnóstico inicial de los 17 requisitos se cumplieron 6 (35 %) y el apartado fue evaluado de NC, después de aplicado el plan de acción se cumplieron 14 requisitos (82 %) y fue evaluado de C (Tabla 2).
Tras la evaluación del apartado, se diseño un plan de acción focalizado en: Designar a la persona competente para gestionar el sistema de documentación; conservar una copia, en formato digital, de los documentos obsoletos más relevantes; establecer los controles para la identificación, el almacenamiento y la protección de los registros; elaborar registros claros, legibles e indelebles; mantener los registros fácilmente identificables y recuperables; asentar en la modificación de los datos la firma y fecha, de modo que pueda leerse la información original que ha sido modificada y elaborar los documentos internos requeridos en el laboratorio.
En la tabla 3 se observaron los resultados de la evaluación de la gestión de los recursos, antes y después de aplicado del plan de acción, en el diagnóstico inicial de los 85 requisitos, se cumplieron 49 (58 %) y el apartado fue evaluado de NC. Después de aplicado el plan de acción, se cumplieron 77 (91 %) y fue evaluado de C (Tabla 3).
El plan de acción para mejorar la evaluación inicial estuvo encaminado a: capacitar al personal en BPLC y bioseguridad, estableciendo un programa que comprenda las necesidades de formación; documentar los requisitos y mantener los registros de las actividades periódicas de limpieza, desinfección y mantenimiento de las instalaciones; documentar y mantener actualizados los certificados de calibración de los equipos; establecer los registros para identificar, manipular, conservar y controlar el uso seguro y la existencia de los materiales de referencia.
En la tabla 4 se observaron los resultados de la evaluación de la gestión del proceso analítico, antes y después de aplicado del plan de acción, en el diagnóstico inicial de los 43 requisitos, se cumplieron 24 (56 %), y el apartado fue evaluado de NC. Después de aplicado el plan de acción, se cumplieron 39 (91 %) y fue evaluado de C (Tabla 4).
El plan de acción para mejorar la evaluación inicial se dirigió a: Redactar una lista informativa con las determinaciones que se realizan en el laboratorio y el tiempo estimado de informe; redactar el modelo de consentimiento informado, para los casos que se requiera; redactar la política de confidencialidad de la información personal; establecer los criterios para la aceptación o rechazo de las muestras; establecer la política para el reensayo y el remuestreo; actualizar la documentación establecida para el sistema de control de la calidad interno; identificar los puntos críticos; redactar el informe de análisis (IA), según la regulación; establecer las instrucciones para enmendar un IA y establecer las instrucciones para emitir una copia de un IA en caso de extravío o deterioro del original.
En cuanto a la evaluación de la gestión de las quejas y las reclamaciones, en el diagnóstico inicial, de los tres requisitos que conforman esta variable ninguno se cumplió, después de aplicado el plan, se elaboraron los documentos requeridos y se cumplió con el 100 %.
El plan de acción estuvo encaminado a: Mantener actualizados los registros para evaluar y responder con inmediatez las quejas y las reclamaciones, así como documentar los motivos por los que alguna queja o reclamación no fue investigada.
En el gráfico 1 se observó que, después de aplicado el plan de acción de los 227 requisitos se cumplieron 150 (66 %), con esta evaluación el laboratorio CP, confirmando la eficacia de las acciones (Gráfico 1).
DISCUSIÓN
La regulación de BPLC D3-2021,(2) establece que el cumplimiento de las BPLC es obligatorio para los laboratorios que participen en actividades reguladoras relacionadas con las funciones básicas del CECMED, así como para los laboratorios que realicen análisis altamente especializados, con marcado impacto para la salud y seguridad de la población.
Por su parte Álvarez,(7) señala que las instituciones de salud que certifiquen sus laboratorios bajo las BPLC, obtendrán reconocimiento por el cumplimiento de requisitos, lo que incrementará su credibilidad. No obstante, la implementación exige un compromiso de mantenimiento continuo.
Los autores opinan que cumplir con las BPLC, es una necesidad del colectivo de trabajadores que requiere el compromiso de la administración; cuando se cumple con los requisitos de la regulación, se demuestra que el laboratorio es competente para realizar los análisis y que los resultados se emiten con calidad y proporcionan confianza en el servicio.
En el estudio realizado por Fuentes y Louro,(4) la evaluación de las BPLC en el diagnóstico inicial es de un 86 % de cumplimiento, encontrando las principales dificultades en la documentación, el equipamiento de trabajo, la capacitación del personal y los recursos humanos.
Las no conformidades se definen como cualquier incidencia o situación que se produce cuando, en la realización de una actividad, se obtiene un resultado que incumple un requisito, las mismas pueden detectarse en cualquier fase o actividad de la gestión de los procesos y de la prestación de servicios. Pueden ser correctivas (ya se han dado) o preventivas (se pueda producir).(8)
El plan de acciones correctivas se refiere al conjunto de correcciones y acciones correctivas que se adoptan en respuesta a las no conformidades identificadas.(8) Según Gascón et al.,(9) el plan de acción es una herramienta de planificación correctiva. Compuesta por acciones proactivas ordenadas para afrontar distorsiones en el funcionamiento de la organización. Constituye un proceso continuo de transformación, para controlar los factores causales y condicionantes. Tiene un carácter de corto y mediano plazo.
Los autores consideran que elaborar un plan de acción para solucionar las no conformidades que se detectan al realizar el diagnóstico del cumplimiento de las BPLC, le aporta varias ventajas al laboratorio clínico, su confección permite organizar y planificar las acciones, además, facilita la búsqueda de soluciones ya que integra a todos los departamentos e involucra al personal.
Después de aplicado el plan de acción para solucionar las no conformidades en el apartado gestión de la documentación, se logró: Designar a la persona competente para gestionar el sistema de documentación, asegurar que el personal autorizado realice los procederes establecidos para la documentación. Establecer la política, los procedimientos y registros para garantizar la protección de la información confidencial, y contar con los recursos necesarios para implementarlos.
Se pudo conservar una copia, en formato digital, de los documentos obsoletos retirados más relevantes y establecer los controles para la identificación, el almacenamiento, la protección, la recuperación y la disposición de los registros. Se elaboraron los documentos internos requeridos.
Para Luitel,(10)la documentación adecuada ayuda a una gestión eficaz del laboratorio. Todas las actividades realizadas deben registrarse tanto de forma manual como electrónica. Es necesaria la documentación para garantizar los problemas de seguridad del equipo y del entorno del laboratorio.
Arias y Medina,(11)consideran que la implementación de un sistema de gestión documental es importante, debido a que contribuye a mejorar la eficacia y la trazabilidad de los procesos, detectar los errores y evitar que se vuelvan a producir, ofreciendo la posibilidad de tener una alta calidad y mejora continua en los procesos que se realizan en los laboratorios.
Después de aplicado el plan de acción para solucionar las no conformidades en el apartado gestión de los recursos, se logró: Adiestrar de forma teórica y práctica a todo el personal, en BPLC y bioseguridad, identificar las necesidades de capacitación del personal. Se estableció plasmar en un registro junto a cada equipo la fecha de la última calibración, así como los registros de uso y establecer los procedimientos para proteger la integridad de los datos, en los equipos automatizados.
Para los autores el laboratorio debe contar con los recursos humanos suficientes que cumplan con las BPLC, que el personal sea calificado y tenga competencia para realizar los exámenes con calidad. Se deben impartir capacitaciones según las necesidades que se establezcan en los laboratorios y de esta forma actualizar los conocimientos y habilidades.
León y Fernández,(12) consideran que entre los atributos de calidad que debe poseer el laboratorio, se deben tener en cuenta el mantenimiento de la infraestructura, condiciones higiénico-sanitarias adecuadas, libre de riesgos para el paciente y los empleados, trato respetuoso y cordial, así como cumplir con la normativa vigente.
Según Pilco et al.,(13) se debe potenciar el liderazgo para que las actividades de capacitación dentro y fuera del laboratorio sean permanentes y su seguimiento continuo, con el fin de obtener mejoras de performance, sostenibles en el tiempo. Valles et al.,(14) expresan que en el laboratorio clínico las medidas de bioseguridad comienzan con la formación adecuada del personal.
Después de aplicado el plan de acción para solucionar las no conformidades en el apartado gestión del proceso analítico, se logró: Disponer de la lista actualizada de los análisis que se realizan en el laboratorio y el tiempo de respuesta establecido. Implementar los criterios para la aceptación o rechazo de las muestras. Establecer una política para el reensayo y el remuestreo y conservar la evidencia del control interno de la calidad.
Se consiguió identificar los puntos críticos de todo el proceso analítico. Los resultados de los análisis efectuados se informaron en un IA con claridad, sin ambigüedades ni tachaduras. Se documentaron las instrucciones para enmendar un IA, en caso que no sea posible emitir uno nuevo y para emitir una copia, en caso de extravío o deterioro del original.
Guamán,(15) considera que los diferentes procesos concernientes a la gestión de las muestras en la fase preanalítica, analítica y postanalítica, son los que representan mayor riesgo en relación a la seguridad del paciente, un mal almacenamiento y transporte de muestras, pueden causar un diagnóstico erróneo, complicaciones, retraso en el manejo de decisiones terapéuticas y errores en la valoración de pacientes críticos.
Para Suardíaz et al.,(16) la atención que el médico de asistencia y el personal del laboratorio concedan a la fase pre analítica, determinará en gran medida, la calidad de los resultados que se van a obtener, porque ningún resultado puede ser mejor que la muestra de la cual se obtuvo.
Según Céspedes et al.,(17) para perfeccionar el control interno de la calidad se deben registrar las acciones que se realizan cada día. Propone una guía para registrar: La verificación de cada método, la planificación del control de la calidad, el resultado de las muestras y de los controladores, el registro de los controladores y calibradores utilizados, así como el mantenimiento de los equipos.
Panunzio,(18) considera que resulta indispensable un sistema de gestión de calidad eficaz, que incluya evaluación interna y programas de evaluación externa, permitiendo conocer el rendimiento del laboratorio en comparación con otros y la armonización de criterios y procedimientos.
Para Tangarife y Montoya,(19) el laboratorio clínico evoluciona adaptándose a cambios científicos tecnológicos, organizativos y de gestión; en toda esta perspectiva el éxito ante los nuevos desafíos para mejorar su eficacia, dependerá de su desempeño a la vanguardia de la gestión de la calidad, asegurando el logro de los mayores beneficios posibles para el paciente y procurando el óptimo uso de los recursos disponibles.
Después de aplicado el plan de acción para darle solución a las no conformidades del apartado gestión de las quejas y las reclamaciones, se logró: Elaborar y mantener actualizados los registros para evaluar, responder con inmediatez las quejas y las reclamaciones y documentar los motivos por los cuales algunas de las mismas no fueron investigadas.
Para Enciso et al.,(20) una queja, petición o reclamo manejado de manera inadecuada implica un usuario o cliente menos y que se divulgue una mala experiencia a otros usuarios; mientras que una queja y reclamo tratados de manera adecuada significa una oportunidad para determinar fallas y elaborar acciones para aplicar un plan de mejora continua.
Los autores opinan que una gestión de quejas y reclamaciones eficiente, es esencial para el laboratorio clínico ya que el tratamiento adecuado que se le brinda al cliente, es la base fundamental para cumplir con sus expectativas y a la vez crea valoraciones positivas del servicio y recomendaciones a otras personas cercanas, proporcionando confianza y publicidad.
Los autores consideran que, el éxito depende de la participación de todos, desde la alta dirección de la institución hasta el último de los empleados. No se deben ver los requisitos de la regulación como un obstáculo para hacer las cosas, sino como un instrumento para que los resultados emitidos por el laboratorio puedan proporcionar confianza.
CONCLUSIONES
Después del estudio de intervención se logró evaluar el cumplimiento de BPLC en el hospital y diseñar un plan de acción para solucionar las no conformidades, así como aplicar las acciones correctivas que se planificaron en el plan de acción para los cuatro apartados seleccionados y lograr su cumplimiento.
La evaluación de las BPLC se cumplió parcialmente y mejoró su cumplimiento, con esto se contribuye a garantizar la confiabilidad en los resultados de los análisis que se realizan, lo que impacta en la calidad del servicio pediátrico.
REFERENCIAS BIBLIOGRÁFICAS
1. George Quintero RS, Toirac Gómez Y, Matos Laffita D, González Rodríguez I, Labori Ruíz R, Guevara Silveira SA. Eficacia, efectividad, eficiencia y equidad en relación con la calidad en los servicios de salud [Internet]. 2021. [citado 23 Nov 2024]; 17 (35). Disponible en:
https://www.medigraphic.com/pdfs/infodir/ifd-2021/ifd2135m.pdf
2. Cuba. Ministerio de Salud Pública. Regulación D 03-21. Buenas prácticas del Laboratorio clínico. 3ed [Internet]. La Habana: CECMED; 2021 [citado 05 Ago 2023]. Disponible en: https://www.CECMED.cu/sites/default/files/adjuntos/Reglamentacion/ResRegBPLC%20firmada.pdf
3.Rodríguez Socarrás IP, Barrera López OL, Carbajales León AI, León Ramentol CC, Quintana Verdecia E. Herramienta para la evaluación del cumplimiento de las buenas prácticas en los laboratorios clínicos [Internet]. La Habana, Cuba: MINSAP; 2022 [citado 02 Abr 2025]. Disponible en: https://convencionsalud.sld.cu/index.php/convencionsalud22/2022/paper/download/6/1577.
4. Fuentes Cortés I, Louro Provedo Y. Diseño e implementación de una metodología de Buenas Prácticas en el departamento de Genética Bioquímica del Centro Nacional de Genética Médica de Cuba. Rev Cuba Genet Comunit [Internet]. 2017 [citado 21 Jul 2024]; 11(1):35-42. Disponible en:https://revgenetica.sld.cu/index.php/gen/article/view/28/38.pdf
5. Ministerio de Salud Pública. Reglamento para la certificación de las buenas prácticas en los laboratorios clínicos [Internet]. La Habana: CECMED; 2022. [citado 25 Ene 2025]. Disponible en: https://www.CECMED.cu/node/add/reguladores_en_circulacion
6. MINSAP. Regulación 3-2009. Buenas Prácticas de Laboratorio Clínico [Internet]. Ciudad de la Habana: CECMED; 2009. [citado 20 Abr 2025]. Disponible en:https://www.sld.cu/galerias/pdf/uvs/patologiaclinica/reg_03-09.pdf
7. Álvarez Guerra S. La norma ISO 9001, las buenas prácticas clínicas y de laboratorio en los ensayos clínicos. Rev cuban med mil [Internet]. 2022 [citado 24 Feb 2025]; 51(3). Disponible en: http://scielo.sld.cu/scielo.php?pid=S013865572022000300001&script=sci_arttext
8. Universidad de Jaén. Manual de Procedimientos Documentados. PD.04 [Internet].2023 [citado 24 Nov 2024] Disponible en: https://www.ujaen.es/gobierno/sigcsua/sites/gobierno_sigcsua/files/uploads/SIGCSUA/DOCUMENTOS_ESTRUCTURA/PD_PS/PD%2004.%20Control%20y%20Tratamiento%20de%20No%20conformidades.%20Ed%2004-2023l.pdf
9. Gascón González D, González González JF, Gascón González D. El plan de acción, plan de actividades y plan de mejora como resultado de investigación. Edusoc [Internet]. 2022 [citado 24 Nov 2024]; 20(2): 178-193. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=8517767
10. Luitel H. Good laboratory practices (GLP): key in success for the disease diagnostic field. J Agriculture Forestry University [Internet].2020[citado 10 May 2025]; 4:307-311. Available from: https://afu.edu.np/sites/default/files/Good%20laboratory%20practices%20%28GLP%29%20Key%20in%20success%20for%20the%20disease%20diagnostic%20field.pdf
11. Arias Guerra EY, Medina Sorza AY. Aporte a la implementación de un sistema de gestión documental para laboratorios de química farmacéutica de la Universidad El Bosque [Internet] [tesis]. Bogotá, Colombia: Universidad El Bosque; 2022 [citado 4 Ene 2025]. Disponible en: https://repositorio.unbosque.edu.co/ítems/bbb2052f-68de-4959-8933
12. León Ramentol C, Fernández Clúa M. Gestión de la función calidad: generalidades, servicios de salud y universidades médicas. Revista Electrónica Dr. Zoilo E. Marinello Vidaurreta [Internet]. 2023 [citado 26 Mar 2025]; 48. Disponible en: https://revzoilomarinello.sld.cu/index.php/zmv/article/view/3138
13. Pilco Yambay CF, Aleaga Trujillo MB, Alarcón Armijo PV, Urquizo Aguiar SG. Impacto de la seguridad del paciente en la calidad de los servicios de Laboratorio Clínico. Revista Científica Arbitrada Multidisciplinaria PENTACIENCIAS [Internet]. 2023 [citado 29 May 2025]; 5(5):121. Disponible en: DOI: https://doi.org/10.59169/pentaciencias.v5i5.699
14. Valles Urrutia FE, Camacho Betancourth LS, Parra Álvarez PF, Suarez Veliz MF. Influencia de las buenas prácticas éticas en los procedimientos de bioseguridad en los laboratorios clínicos del cantón la Concordia de la provincia de Danto Domingo de los Tsáchilas - Ecuador en el periodo 2023. Revista Multidisciplinaria Arbitrada de Investigación Cientifíca [Internet]. 2024 [citado 25 May 2025]; 8(1): 304-322. Disponible en: https://www.investigarmqr.com/ojs/index.php/mqr/article/view/891
15. Guamán Sánchez MF. Gestión de calidad y su importancia en la garantía de resultados de los laboratorios clínicos de Cuenca. Revista Multidisciplinaria Arbitrada de Investigación Cientifíca [Internet]. 2023 [citado 25 May 2025]; 7(4): 1795-1808. Disponible en:
https://doi.org/10.56048/MQR20225.7.4.2023.1795-1808
16. Suardíaz Espinosa ME, Aguirre Guillot J, Garciarena Peñate Q, Alonso Rodríguez CA. Importancia de la fase preanalítica para el laboratorio clínico. Rev Acta Médica [Internet]. 2021 [citado 23 Abr 2025]; 22(1). Disponible en: https://www.medigraphic.com/cgibin/new/resumen.cgi?IDARTICULO=103979
17. Céspedes Quevedo MC, Gondres Legró KM, Cuadra Brown Y, Mora González CA. Guía práctica para el perfeccionamiento del control interno de calidad en el laboratorio clínico. Medisan [Internet]. 2022 [citado 3 Ago 2024]; 26(2): 455-474. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S102930192022000200455&Ing=en.EpubMar28,2022.
18. AP. Evaluación externa de la calidad del laboratorio clínico. Revista Enfermería Investiga [Internet]. 2022 [citado 3 Ago 2024]; 7(2): 56–61. Disponible en: https://revistas.uta.edu.ec/erevista/index.php/enfi/article/view/1614
19. Tangarife Castaño VJ, Montoya Delgado AM. Mandatory Quality Assurance System in Health: application to the clinical laboratory. Revista Medicina & Laboratorio [Internet].2023 [citado 3 Nov 2024]; 27(2).157-173. Disponible en: https://www.medigraphic.com/cgibin/new/resumenI.cgi?IDARTICULO=110842.
20. Enciso López H, Acosta Granados JP, Castro Malaver RS. Propuesta de mejora al proceso de tratamiento de quejas fundamentado en la GTC ISO 10002:2018 en COLCAN S.A.S [Internet]. Bogotá, Colombia: Universidad Santo Tomás; 2021. [citado 8 Ene 2025] Disponible en: http://hdl.handle.net/11634/38775
CONFLICTOS DE INTERESES
Los autores declaran no tener conflictos de intereses.
DECLARACIÓN DE AUTORÍA
Yudeynis Marisol Díaz-Alonso (Conceptualización e ideas. Curación de datos. Análisis formal. Adquisición de fondos. Investigación. Metodología. Administración del proyecto. Recursos. Software. Supervisión. Validación. Visualización. Redacción del borrador original. Redacción - revisión y edición).
Isis Patricia Rodríguez-Socarras (Conceptualización e ideas. Curación de datos. Análisis formal. Adquisición de fondos. Investigación. Metodología.Recursos. Software. Supervisión. Validación. Visualización. Redacción del borrador original. Redacción - revisión y edición).
Ubaldo Roberto Torres-Romo (Análisis formal. Investigación. Metodología. Recursos. Software. Supervisión. Validación. Visualización. Redacción del borrador original. Redacción - revisión y edición).
Dayami Bembibre-Mozo (Análisis formal. Investigación. Metodología. Recursos. Software. Supervisión. Validación. Visualización. Redacción - revisión y edición).
Tahymiris Pérez-Milán (Análisis formal. Investigación. Metodología. Recursos. Software. Supervisión. Validación. Visualización. Redacción del borrador original. Redacción del borrador original. Redacción - revisión y edición).
.